Attraktive und sichere chemische Experimente im Zusammenhang mit Rahmenlehrplänen
Photochemischer Blaudruck (Cyanotypie)
Photochemischer Blaudruck (auch bekannt unter dem Begriff Cyanotypie, aus dem grichechischen kyanos – blau) ist eine der historich ältesten fotographischen Techniken, die intensiv blaue Bilder liefert. Heute wird sie zu den sogennanten alternativen photographischen Prozessen gezählt.
Dieser Prozess wurde 1842 durch den englischen Naturwissenschaftler und Astronomen Sir John Frederick Herschel (1792-1871) entwickelt. Cyanotypie war somit die historich dritte photographische Technik nach Daguerrotypie und Talbotypie (Kalotypie), mit der man stabile fotografische Bilder hestellen konnte. Im Unterschied zu den vorherigen Silber-basierten Techniken basiert Cyanotypie auf der Lichtempfindlichkeit von Eisen(III)-Komplexen, die sie vergleichsweise preiswert machen. Herschel selbst ist Author von den heutzutage gängigen Ausdrücken wie Negativ, Positiv, Photografie und Aufnahme.

Die intensive, man könnte sogar sagen schrille blaue Farbe von Cyanotypen eignete sich nur für eine begrenzte Anzahl von Motiven, z.B. war sie für Darstellungen von Landschaften und Porträten, die im 19. Jahrhundert die häufigsten Themen waren, völlig unakzeptabel. Peter Henry Emerson (1856–1936), englischer Photograf und Gründer der naturalistischen Photografie, hatte damals erklärt: „Nur ein Vandal würde eine Landschaft rot oder in Cyanotypie drucken“.
Die Technik der Cyanotypie fand viel mehr Begeisterung in technischen Kreisen zur Darstellung von Kopien von Bau- und Maschinenzeichnungen, wo die blaue Farbe nicht mehr störte. Von der ursprünglichen Vervielfältigung, die man im Sonnenlicht komplett manuell durchführte, ging man über komerziell erhältliche lichtempfindliche Papiere, elektrisch betriebene Beleuchtungsapparate bis hin zu vollautomatischen Kopiergeräten der zwanziger Jahre des 20. Jahrhunderts über, die die Beleuchtung, Entwicklung, Fixierung und Trocknung der Kopien übernahmen.
Zum Beispiel hat man beim Kopieren von technischen Zeichnungen eines englischen Kriegsschiffs über 1000 m2 des Cyanotypiepapiers verbraucht.
Ab den vierziger Jahren des 20. Jahrhunderts wurde dieser feuchte Vervielfältigungsprozess durch einen benutzerfreundlicheren Diazotypieprozess (Ozalid®) und anderen Trockenprozessen (Xerox®) ersetzt.
Die Cyanotypie wurde durch Photographen des 19. Jahrhunderts als preiswerte Technik zur Herstellung von Testdrücken von Photografien verwendet bevor man zu der Finalprojektion auf die Papiervorlage überging.
Anna Atkins (geb. Children, 1799-1871), englische Botanikerin, war die erste Photographin der Welt und ihre ersten Versuche sind mit der Cyanotypie eng verbunden. Dank Ihrer Bekanntschaften mit den Mitgliedern der Königlichen Gesellschaft William Henry Fox Talbot und Sir John Herschel erfuhr sie über die damals neu entdeckten fotografischen Verfahren.
Mit Hilfe der Cyanotypie auf lichtempfindlichem Papier hatte sie Photogramme (direkte photografische Abdrücke) von auf britischen Inseln vorkommenden Meersealgen angefertigt. Diese Arbeit mündete in das erste Werk namens „Photographs of British Algae: Cyanotype Impressions“, das 1843 in einigen Exemplaren herausgegeben wurde. Dieses Buch war das erste photographisch illustrierte Buch der Geschichte und ein klarer Beweis davon, dass die Fotografie sowohl estetisch als auch wissenschaftlich von Nutzen sein kann.

Der photochemische Blaudruck wurde in den letzen Jahrzehnten durch die künstlerische Kommunität als eine erschwingliche, technisch relativ einfache und estetisch interessante Technik für Bildung von aussergewöhnlichen Motiven auf Papier- und Textiloberflächen entdeckt und wird somit in verschiedenen kreativen Workshops gerne benutzt.
Die Vorteile der Cyanotypie liegen in der einfachen Verarbeitung der Kopien nach der Exposition – die Entwicklung und Fixieren wird durch einen Schritt gemacht – durch Auswaschen im Wasser.
Fast jeder, der die Cyanotypie zum ersten Mal mit eigenen Augen sieht, wird dadurch fasziniert, wie das Licht auf dem lichtempfindlichen Papier sichtbare Bilder der Vorlage hinterlässt, z.B . die Bilder der Farnblätter, der Vogelfedern oder einer Negativvorlage und wie dieses Bild durch Auswaschen in Wasser eine intensiv blaue Färbung erhält.
Dank der niedrigen Toxizität der benutzten Chemikalien und Arbeit mit relativ verdünnten Lösungen lassen sich in Kunstunterrichtstunden, bzw. in interdisziplinären Projekten kreative und eindrucksvolle Aktivitäten machen.
Wie funktioniert Cyanotypie?
Die Cyanotypie basiert auf der Bildung vom Berlinerblau, respektive Turnbull-Blau[1] (in der englischsprachigen Literatur besser bekannt unter dem Begriff Preussischblau – „prussian blue“[2]) durch die Reaktion eines Eisen(II)-Salzes mit rotem Blutlaugensalz (Trikaliumhexacyanidoferrat(III)) auf den Stellen, wo auf das lichtempfindliche Papier das Licht einwirkt. Das notwendige Eisen(II)-Salz wird durch eine photochemische Reaktion generiert.

Die klassische Form der Cyanotypie beruht darauf, dass das Papier mit einer Lösung eines lichtempfindichen Gemisches zweier Chemikalien bestrichen wird – dem lichtempfindlichen Eisen(III)-Komplex mit einer leicht oxidierbaren mehrwertigen Carbonsäure, meistens Zitronensäure oder Oxalsäure, und Hexacyanidoferrat(III)- dem roten Blutlaugensalz. Den resultierenden Anstrich lässt man vor Licht geschützt trocknen und nachher wird das sensibilisierte Papier mit einer Negativvorlage oder verschiedenen Gegenständen oder lichtundurchlässigen Vorlagen bedeckt und der Einwirkung von UV-Licht (entweder aus der UV Lampe oder Sonnenlicht) ausgesetzt.
Der lichtempfindliche Eisen(III)-Komplex bildet das Kernstück des ganzen Prozesses. Das zentrale Eisen(III)-Atom koordiniert sechs Carboxylatgruppen, die in den Anionen der Dicarbonsäure (oder Tricarbonsäure) enthalten sind. Im Falle von Oxalsäure koordiniert Eisen drei Oxalatanionen und es handelt sich dabei um einen oktaedrischen Tris(oxalato)ferrat(III)-Komplex, der bei Normalbedingungen als Kaliumsalz eine stabile, kristalline, relativ gut wasserlösliche grasgrüne Verbindung ist.
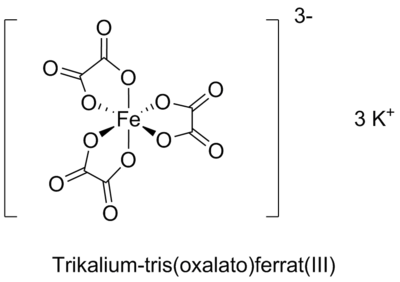
Die ursprüngliche Rezeptur von Sir Herschel ging aus dem Ammoniumsalz der Zitronensäure heraus; die späteren industriellen Rezepturen sind jedoch auf den Oxalatprozess übergegangen, weil er einen schnelleren Druck mit besserem Kontrast ermöglichte, zudem waren solche Rezepturen weniger zum Schimmelbefall geneigt (Ammoniumzitrat ist ein relativ guter Nährboden für Schimmel, weil es sowohl Kohlenstoff als auch Stickstoff in einer für die Mikroorganisme gut bioverfügbaren Form liefert).
Der violette und ultraviolette Teil des Lichtspektrums haben eine genügend hohe Energie zur Anregung des Tris(oxalato)ferrat(III)-Komplexes. Der angeregte Komplex ist instabil und es kommt zu einer Redoxreaktion – das Zentrale FeIII-Atom als Oxidationsmittel oxidiert das naheliegende Oxalatanion[3] zum Kohlenstoffdioxid, während es zu FeII reduziert wird. Die gerade entstandenen Fe2+-Kationen verbinden sich gleich im Inneren der Papierfaser mit rotem Blutlaugensalz zum unlöslischen Niederschlag vom Berliner Blau. Die lichtempfindliche Reaktion lässt sich in vereinfachter Form folgendermassen beschreiben:

An Stellen, die nicht belichtet wurden, bleiben die Ausgangschemikalien unverändert. Das Auswaschen der unbelichteten Stellen unter fliessendem Wasser entfernt alle gut löslichen Chemikalien und hinterlässt nur das blaue Bild, das in der Struktur der Papierfaser eingebettet ist.
Interessant ist, dass eine längere Expositionszeit zur Vertiefung des Ausmasses der Reduktion durch Oxalatanionen führt, so dass die ursprüngliche blaue Farbe des Berliner Blaus grau wird. Dies ist dadurch bedingt, dass Berliner Blau bis zum Berliner Weiss der Zusammensetzung FeII2[FeII(CN)6] reduziert wird; das ist normalerweise eine gute Indikation dafür, dass die Exposition unterbrochen werden sollte. Nach dem gründlichen Auswaschen erhält das Bild langsam die blaue Farbe durch die Oxidation mit Luftsauerstoff. Diesen Prozess kann man drastisch beschleunigen indem das Cyanotyp in verdünnte Wasserstoffperoxidlösung eingetaucht wird. Das Resultat ist ein augenblickliches und visuell sehr attraktives Erreichen vom Vollkontrast.



Ein so hergestelltes Bild hat eine intensive blaue Farbe und ist sehr stabil gegenüber Sauerstoff und Licht (die Originalcyanotypen von Sir Herschel sind auch nach 160 Jahren Lagerung im Museum immer noch aüsserst konstrastvoll), ist relativ stabil gegenüber schwachen und verdünnten Säuren, aber instabil gegenüber Alkalien, die es aggresiv verbleichen. Die Anätzung des Bildes mit einer verdünnten Natriumcarbonatlösung, anschliessendes Auswaschen und ein darauffolgendes Bad in starkem schwarzen Tee oder Kaffee führt zu einer angenehmen braunen Tonierung.
Die alkalische Instabilität der photochemichen Blaudrücke ist der Hauptgrund, weshalb man Papiere mit hohem Gehalt an alkalisch reagierenden Zusatzstoffen (Kreide und andere Zusätze) vermeiden sollte, weil sie eine Bildvergilbung, Bildung von braunen Flecken oder Inhibition der photochemischen Reaktion verursachen können. (Die Photochemische Zersetzung des photoaktiven Komplexes läuft am besten bei schwach saurem pH)
Die Cyanotypie ist nicht nur auf Papier begrenzt, sondern man kann auch ebenso gut auf andere Oberflächen drucken, z.B. auf Holz oder Baumwolle und somit estetisch interessante Gegenstände kreieren.
In der folgenden Anleitung werden wir Experimente mit Cyanotypie durchführen und lernen dabei die Möglichkeiten kennen, wie dieser Prozess nicht nur im Chemieunterricht, sondern auch im Kunst- und Biologieunterricht verwendet werden kann.
___________________________________________
[1] Berliner Blau wurde im 19. Jahrhundert eine Zeit lang zur Färbung von preussischen Uniformen verwendet.
[2] Früher meinte man in der Fachliteratur, dass Berliner Blau, das durch die Reaktion von Fe3+ Kationen mit gelbem Blutlaugensalz K4[Fe(CN)6] entsteht, eine andere Verbindung als Turnbullblau ist, das durch die Reaktion von Fe2+ Kationen mit rotem Blutlaugensalz K3[Fe(CN)6] entsteht. Die gegenwärtige Forschung zeigt aber, dass die leichten Farbunterschiede von diesen zwei Farbstoffen eher auf die Herstellungsmethode, Charakter der Verunreinigungen und Partikelgrösse zurückzuführen sind.
[3] Oxalsäure wird als Reduktionsmittel und titrimetrischer Standard z.B. bei manganometrischen Titrationen verwendet, wo sie zu Kohlenstoffdioxid oxidiert wird.



